Conceptualizando VI: Comportamiento de la glucosa y la 18F-FDG en tumores malignos, con enfoque en tumores de cabeza y cuello
Luis Felipe Colmenter1, María Bastianello1, Flor María Quintero Álvarez1, Enrique Estrada1.1 - Grupo Conceptualizando (Argentina - Colombia - México - Venezuela).
Introducción
El cáncer de cabeza y cuello representa alrededor del 2 % de los nuevos casos de neoplasias malignas a nivel mundial(1). Aproximadamente 90% de estos cánceres consisten en carcinoma epidermoide (Ca) que surge del epitelio oral; el 10% restante consistirá en tumores malignos de las glándulas salivales, melanomas, sarcomas de los tejidos blandos y huesos maxilares, linfomas No Hodgkin y los poco frecuentes tumores odontogénicos malignos; por último los tumores metastásicos de cánceres primarios ubicados en otras partes del cuerpo(1).
Los tumores de cabeza y cuello son en general de rápida proliferación, con un tiempo medio de duplicación de 6-7 días(2). Recordemos que aproximadamente 30 duplicaciones (= 109 células), son necesarias para alcanzar un volumen de un centímetro cúbico, siendo la palpación uno de los primeros signos tumorales que pueden llegar a ser detectables(3). El tiempo de duplicación del tumor puede estar influenciado por el sistema inmune del huésped y por factores micro-ambientales, incluyendo el fenómeno de la angiogénesis.
Los carcinomas epidermoides de cabeza y cuello (CaECC) constituyen un grupo heterogéneo de neoplasias que tienen en común una asociación causal con la exposición al tabaco, alcohol y virus del papiloma humano. El curso clínico de estos tumores es difícil de predecir sobre la base de criterios clínico-patológicos.
Estadificación
La estadificación clínica de los tumores de cabeza y cuello depende principalmente de la clasificación TNM, sistema de estadificación emanado de la American Joint Cancer Committee (AJCC). Desde su primera edición en 1977 se ha actualizado en diferentes ocasiones; la sexta y última edición, publicada en el año 2003, describe la extensión anatómica del cáncer en el momento del diagnóstico inicial y antes de la aplicación definitiva del tratamiento. Se basa en el tamaño del tumor (T), la extensión a los ganglios linfáticos (N), y la presencia de metástasis a distancia (M). Cada uno de estos elementos conlleva una numeración de 1-4 que representa la extensión progresiva de la enfermedad.
La Etapa I (T1N0) corresponde a Ca de cavidad oral con una alta tasa de curación (alrededor del 80%-90%), por lo menos respecto a supervivencia de cinco años, mientras que los Ca en etapa IV, tienen una tasa de curación de sólo un 20 %. Los parámetros biológicos no se incluyen en el procedimiento de estadificación.
Imágenes diagnósticas
Las imágenes morfológicas presentan limitaciones con relación a la extensión, respuesta al tratamiento y estatificación tumoral. En un estudio comparativo Feinmes-set et al. Encontraron que la tomografía computarizada (CT) no ofrece ninguna ventaja sobre el examen físico y no debería ser utilizada para decisiones de cambios de conducta en cáncer de cabeza y cuello. La medición del tamaño de los ganglios linfáticos afectados demostró que los ganglios ocultos entran en el mismo rango que los ganglios normales y por lo tanto no pueden ser diferenciados(4).
La Tomografía por Emisión de Positrones (PET) valora una serie de características biológicas del tumor, incluyendo metabolismo de la glucosa, proliferación celular, hipoxia y transporte y síntesis de aminoácidos. El PET con flúor-18-fluorodeoxiglucosa (FDG) puede complementar las anteriores limitaciones mencionadas de la CT. Las recientes mejoras en relación a la instrumentación PET y el desarrollo de nuevos trazadores que apuntan a la proliferación celular y el transporte de aminoácidos, prometen aumentar la aplicación de la PET en pacientes con cáncer en el futuro(5).
Genética
Dada la complejidad genética de los cánceres de cabeza y cuello, no es de extrañar que las correlaciones con cada una de las anomalías genéticas también hayan sido decepcionantes. Varios autores han sugerido que los patrones globales de la expresión génica pueden ser utilizadas para subgrupos de pacientes con cáncer.
Proliferación celular
El ciclo celular es un conjunto ordenado de sucesos que conducen al crecimiento de la célula y a su división en dos células hijas; las células que no están en división no se consideran dentro del ciclo celular. Se distinguen varias fases: la fase de reposo (G0), fase de síntesis proteica (G1a), síntesis de ARN (G1b), síntesis de material genético o ADN (fase S), de nuevo síntesis de proteínas (G2), y por último división celular (M). Según el tipo y función de la célula, ésta tiene más o menos actividad proliferativa y el ciclo puede variar según diversas condiciones: intervención farmacológica, radiaciones, etc. Las células que se encuentran en el ciclo celular se denominan «proliferantes» y las que se encuentran en fase G0 se llaman células quiescentes(12).
Varios métodos se recomiendan para la estimación de la tasa de proliferación en cáncer de cabeza y cuello: el índice de marcación con 3H-timidina (TLI), el análisis de citometría de flujo de ADN o ARN y el contenido de la medida del antígeno Ki-67 patrón de tinción, antígeno utilizado para el diagnóstico de algunos tumores odontogénicos.
El método TLI requiere la aplicación de un compuesto radiactivo y sólo es sensible a las células en fase S. La importancia biológica para el antígeno Ki-67 se encuentra aún sin resolver en la actualidad(13). Por otra parte, van Dierendonck et al.(14) encontraron que las células no proliferantes pueden retener el antígeno Ki-67 durante un período considerable de tiempo, por lo cual la tinción del Ki-67 no es en todos los casos una medida confiable de la fracción de proliferación celular.
Podemos estudiar una estimación de la agresividad de los tumores mediante citometría de flujo. La citometría de flujo (CMF) se define como la medición de las características de dispersión de luz y fluorescencia que poseen las células conforme se les hace pasar a través de un rayo de luz.
La CMF puede ser empleada para estudiar características estructurales y funcionales de células o partículas en suspensión. Las aplicaciones fundamentales de esta técnica se dan en biología y medicina y son la identificación de antígenos celulares mediante métodos de inmunofluorescencia y el estudio del contenido de ADN y fases del ciclo celular. El problema principal del análisis de CMF es la presencia de residuos de fondo; esto puede dar lugar a diferencias entre los valores de citometría de flujo y la TLI.
La ploidía tumoral (número de juegos completos de cromosomas en una célula biológica) y la actividad de proliferación son parámetros ampliamente aceptados como indicadores del comportamiento biológico de tumores malignos, y los tumores con características diploides (número doble de cromosomas) en particular, se asocian con un pronóstico relativamente bueno. La medición de la ploidía del tumor probablemente se convierta en un valioso complemento a la evaluación clínica e histopatológica de cáncer(15,16).
Entendemos como Índice de ADN (ID) el cociente entre la moda del pico G0G1 de la población problema y la moda del pico G0G1 del control (en %); esto se obtiene por medio de técnicas de análisis celular como la CMF. Atkin et al. estudiaron el valor pronóstico de las modalidades de ADN y otros factores en los tumores malignos de 1465 casos. Estos autores observaron que los pacientes con un ID bajo (corto diploide), en general tuvieron una mejor tasa de supervivencia(17). La diploidía implica la misma carga genética de las células madre, a diferencia de las células aneuploides o poliploides que pueden ser más desdiferenciadas. Otros estudios muestran que el uso de microanálisis de DNA para medir los patrones globales de la expresión génica en el tejido, puede ser utilizado como un predictor de pronóstico en el CaECC(18).
La imagen basada en la genómica y la proteómica va a permitir seleccionar poblaciones e individuos “con riesgo” de padecer una determinada patología antes de que aparezcan los síntomas clínicos, identificando la existencia, localización y extensión de las bases de la enfermedad, estratificando el riesgo y posibilitando la realización y el control de tratamientos diseñados para cada paciente. Estas técnicas de imagen molecular deben generar, para ser eficaces, información tanto funcional como estructural. La utilización de sondas de imagen junto a equipamientos avanzados, permite investigar numerosos complejos moleculares y estructuras celulares. La imagen metabólica permite, directa o indirectamente, recoger y seguir la distribución témporo-espacial de los procesos moleculares o celulares, con aplicaciones no solamente clínicas (diagnósticas y terapéuticas), sino también básicas (bioquímicas y fisiológicas).
En la parte clínica, la Medicina Nuclear y la Radiología están necesariamente obligadas a trabajar conjuntamente para liderar el desarrollo, la implantación y la evaluación tecnológica de la imagen molecular. La imagen metabólica dota a los especialistas relacionados con la imagen médica, la posibilidad de avanzar sustancialmente en el diagnóstico precoz, la estratificación del riesgo y el pronóstico, así como la monitorización del tratamiento de numerosos procesos biológicos y celulares relacionados con la enfermedad(19).
Minn et al.(20) estudiaron el contenido de ADN nuclear y el porcentaje de células proliferativas (S + G2 / M); esto se comparó con la captación de FDG por el tumor primario y/o metástasis cervicales en todos los pacientes. La acumulación de FDG no se correlacionó con el grado histológico de los tumores, pero hubo una clara correlación (r = 0,86, p <0,001) entre la proporción de las células en fases del ciclo celular S + G2 / M y la intensidad de la acumulación de FDG. La captación de FDG por el tumor también se correlaciona con el porcentaje de células en fase S (r = 0,82, p <0,001). El resultado sugiere que el metabolismo de la glucosa (medida por la captación de FDG) se asocia con la actividad proliferativa del tumor. Por lo tanto, las imágenes con 18F-FDG PET pueden ofrecer un nuevo método para evaluar la agresividad del crecimiento del cáncer humano en vivo. Esto nos lleva a que la captación de FDG puede ser correlacionada con la clasificación histológica de malignidad de los tumores(21,22). Alavi et al. proponen que estos datos deben ser utilizados para predecir la tasa de supervivencia(23).
El papel de la proteína P53 en los cánceres de cabeza y cuello no está muy claro. El mecanismo preciso por el cual actúa la proteína P53 es desconocido, aunque actualmente el modelo más aceptado sugiere que la proteína nativa reconoce el ADN celular dañado. Esto aumenta la síntesis de la proteína, que actúa deteniendo el ciclo celular y permite reparar el daño infringido sobre el ADN. Cuando no se consigue reparar la lesión del ADN, la proteína es capaz de desencadenar la muerte celular programa o apoptosis. Por el contrario, si el gen ha mutado, la proteína no es operativa y la célula continúa portando su defecto a nivel del ADN a través del ciclo celular. Esta situación favorecerá que surjan clones de células genéticamente inestables, los cuales darán lugar al desarrollo del cáncer(24,25,26).
Glucosa y transportadores (GLUTs)
A nivel molecular, la captación de glucosa mediada por proteínas específicas de transportadores de glucosa representa una expresión alterada en las neoplasias de cabeza y cuello. Sin embargo, no se sabe cuando se produce la alteración en el desarrollo de Ca epidermoides. Se ha estudiado la expresión de diferentes proteínas transportadoras de glucosa (GLUT 1, 2, 3 y 4) mediante inmunohistoquímica en una variedad de lesiones mucosas pre-malignas y malignas en cabeza y el cuello. Se ha observado débil expresión de GLUT 1 en la mucosa normal; por el contrario, en las lesiones potencialmente malignas la expresión GLUT 1 es muy marcada y se correlaciona bien con el grado de displasia. En los Ca epidermoides y sus metástasis, GLUT 1 se incrementa; en cambio, GLUT 2, 3 y 4 no fueron detectados en los tejidos epiteliales examinados. La mayor expresión de GLUT 1 en lesiones displásicas (y su expresión sostenida en el CaECC), indicarían que los cambios de su expresión son los primeros eventos durante el desarrollo del CaECC. Por lo tanto, la detección de GLUT 1 podría ser un marcador fiable para el diagnóstico de lesiones potencialmente malignas (leucoplasia y eritroplasia)(27,28,29).
La Tomografía por Emisión de Positrones (PET) en relación con los tumores malignos de cabeza y cuello, ha demostrado que el crecimiento del tumor y la captación elevada de glucosa están asociados (fig. 1). El hecho de que las lesiones potencialmente malignas con un aumento de GLUTs no se puedan detectar clínicamente por PET se explica por la pequeña dimensión de las displasias epiteliales y la limitada resolución del PET (5 mm)(27).
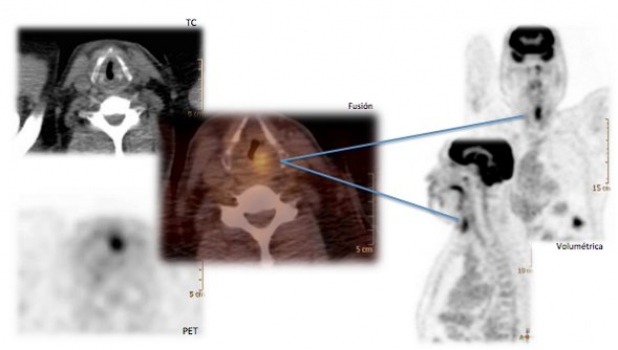
El aumento de GLUT 1 y la disminución del almacenamiento de glucógeno en lesiones epiteliales displásicas parece estar relacionado con desdiferenciación celular. Estas afirmaciones sobre las proteínas transportadoras de glucosa GLUTs como facilitador en el CaECC, puede abrir la posibilidad de nuevas estrategias terapéuticas. Una de éstas podría estar relacionada con la inhibición de GLUT 1 con productos químicos tales como phloretin, un conocido inhibidor del transporte de glucosa transmembrana(30). El problema fundamental es que debido a que los GLUT 1 juegan un papel crucial en el suministro de glucosa al cerebro, cualquier agente terapéutico debe tener como prioridad no atravesar la barrera hematoencefálica, con el fin de evitar los efectos secundarios de déficit de glucosa del sistema nervioso central (SNC)(30). Autores brasileños estudiaron GLUT1 y GLUT3 como marcadores potenciales para el pronóstico en el carcinoma epidermoide de cavidad oral y observaron que la expresión de GLUT1 se presentó en la mayoría de los casos pobremente diferenciados; por el contrario, los tumores bien diferenciados mostraron ausencia de GLUT1 y los pacientes con presencia de GLUT3 revelaron mayor riesgo de recidiva. Concluyen que el aumento del metabolismo glicolítico de estas proteínas es un indicador de la agresividad de las células tumorales(31).
Hipoxia
Un alto nivel de hipoxia en los tumores sólidos es un factor pronóstico adverso en la evolución de los pacientes de cáncer después del tratamiento. El suministro insuficiente de oxígeno en la sangre se ha relacionado con una pobre respuesta del tumor a la radioterapia(32,33). Esta resistencia se refiere, en parte, a los efectos radiobiológicos de la hipoxia.
La hipoxia es también un marcador de un fenotipo tumoral agresivo y se asocia con un mal pronóstico y con alta posibilidad de recidiva después de la cirugía(34,35). Además, la hipoxia está implicada en la resistencia de los tumores a algunos agentes oncológicos(36) .
La hipoxia es un fenómeno común en el CaECC y aumenta la resistencia a la quimioterapia y radioterapia. La cuantificación de la hipoxia con PET se encuentra bajo estudio y puede comenzar a representar un pre-requisito para evaluar el uso de medicamentos radiosensibilizantes y monitorizar la respuesta de esta terapia en grupos seleccionados de pacientes. Aunque la F18-FDG PET-CT continua siendo de gran utilidad en monitorizar la respuesta al tratamiento de los CaECC, otros radiofármacos PET pueden tener un papel en identificar pacientes que se beneficien de otras estrategias de tratamiento, incluyendo agentes biológicos tales como inhibidores de los receptores de factor de crecimiento epidérmico o inhibidores del factor de crecimiento del endotelio vascular(37).
Existen radiofármacos como el 18F-Fluoromisonidazole que se acumulan selectivamente en el tejido hipóxico, con mínima captación en tejidos con oxigenación normal. Este trazador se ha empleado en diversos trabajos para la caracterización biológica de los tumores de cabeza y cuello, previo al tratamiento con radioterapia, proporcionando información pronóstica de respuesta al tratamiento(38). Esta caracterización permite una terapia molecular más específica, adicional a la radioterapia, en pacientes con hipoxia tumoral identificada en la PET- CT(38).
Angiogénesis
La formación de nuevos vasos sanguíneos (angiogénesis) es esencial para el crecimiento tumoral y para las siembras metastásicas(39). En un estudio en tumores cerebrales con ratas, Watanabe et al.(40) analizaron la relación entre angiogénesis y ciclo celular y encontraron que la distribución del flujo sanguíneo cerebral no se correlacionó con la fracción de fase S del ciclo celular. Otros estudios han reportado resultados similares en tumores de cabeza y cuello utilizando PET con 18F-FDG. Los valores de captación de FDG no mostraron ninguna dependencia de la perfusión con relación a la proliferación en estos tumores(40,41).
Los nuevos vasos producto de la angiogénesis inducida por el tumor son estructuralmente anormales y disfuncionales, entregando menos oxígeno y nutrientes al tumor cuando se los compara con los vasos normales. Estas características son precisamente las que causan limitación de la concentración de los medicamentos en el tumor(42,43) y promueven la presencia de hipoxia en sub-regiones del tumor. La hipoxia, a su vez, es promotora de angiogénesis tumoral(44) .
La angiogénesis está regulada por varias moléculas, pero la más conocida es el factor de crecimiento del endotelio vascular (VEGF). La terapia anti-angiogénica está particularmente dirigida contra esos nuevos vasos sanguíneos formados y puede reducir o eliminar la suplencia de nutrientes necesarios para el crecimiento tumoral(45). Paradójicamente, estos medicamentos pueden mejorar la distribución de la droga en el tumor y reducir los niveles de hipoxia intratumoral debido a que elimina vasos tumorales disfuncionales y reduce la presión intersticial intratumoral(46).
Una alta expresión del VEGF se asocia con un peor pronóstico, correlacionándose con alta tasa de recurrencia locorregional y baja sobrevida libre de la enfermedad(47). El aumento de la angiogénesis se presenta en varios tumores humanos, incluyendo el CaECC y esto conlleva a progresión del tumor y de sus metástasis. El VEGF ha demostrado ser clave en la regulación de la angiogénesis; por tanto, la demodulación (down modulation) del VEGF usando oligonucleótidos podría ser una terapia potencial para inhibir la angiogénesis en el CaECC(48), razón por la cual existe interés en la terapia antiangiogénica de estos tumores.
El Bevacizumab es un anticuerpo monoclonal IgG recombinante humanizado contra VEGF y ha sido estudiado en combinación con quimioterapia en los pacientes con CaECC(49). También hay estudios en fase I de combinación del Bevacizumab con inhibidores de la tirosina quinasa(50). Experimentalmente, se ha observado un efecto sinérgico al combinar el Bevacizumab con los inhibidores de la tirosina quinasa de los receptores del factor de crecimiento epidérmico (EGFR)(51).
Hoy en día podemos evaluar cambios en el flujo vascular tumoral por medio de la CT con contraste o medianteesonancia magnética con secuencias de perfusión. Sin embargo, podemos obtener imágenes más específicas utilizando PET con 18F-fluciclatide, un péptido RGD. Mena et al. utilizaron imágenes PET en la detección de la angiogénesis del tumor a través de la expresión de la integrina vβ3 utilizando como radiotrazador la 18F-fluciclatide. La intensidad de la acumulación del péptido marcado se correlaciona con la presencia de células endoteliales activas y cuantitativamente con la densidad de los microvasos. Las imágenes con 18F-péptido RGD en HNSCC (Carcinoma de cabeza y cuello) parece confiable: en un estudio piloto con 11 pacientes, la captación del trazador fue detectada en 10 de 12 lesiones primarias (SUV 2,2 – 5,8) con razonable contraste, con una relación tumor/pool sanguíneo de 2,86/1,1. Este o similares radiotrazadores podrían ser potencialmente usados en pacientes tratados con drogas antiangiogénicas y monitorizar la respuesta a tales terapias(52).
El receptor del factor de crecimiento epidérmico, el EGFR, también denominado ErbB1/HER1, pertenece a la superfamilia de receptores localizados en la membrana plasmática que presentan actividad tirosina-quinasa intrínseca(53). La sobreexpresión del EGFR ha sido observado en una amplia variedad de tumores malignos; esta expresión alterada en tumores humanos ha sido revisada por Gullich et al.(54,55). La sobreexpresión del receptor del EGFR está frecuentemente asociada con CaECC, mama, vejiga y en los gliomas(56,57). De particular importancia resulta el hecho de que la sobreexpresión del EGFR ha mostrado estar relacionado con un mal pronóstico en varios tipos de tumores(58,59).
Aunque algunos estudios sugieren que los CaECC que expresan el EGFR serían candidatos para terapia con inhibidores del EGFR, la apropiada selección de pacientes para esta terapia continúa siendo un desafío, con procentajes de 10% de respuestas objetivas, dependiendo del agente específico(60). El Cetuximab, un anticuerpo monoclonal quimérico IgG1 dirigido contra el EGFR dominante compite en el sitio de enlace del receptor y bloquea el receptor de la tirosina quinasa(61). El Cetuximab se puede usar en combinación con varios quimioterapéuticos y también aumenta la eficacia de la radioterapia(62).
Actualmente se han desarrollado una nueva terapia anti-receptores del EGFR (anti-EGFR) con una secuencia de receptores del EGFR bajo el control del promotor U6 en la columna vertebral pNGVL. Muthukrishnan et al.(63) estudiaron el valor de estas terapias con la FDG PET-CT como marcador biológico metabólico para la respuesta terapéutica dirigida, además de la CT estándar, basada en los Criterios de Interpretación de la Evaluación a la Respuesta de los Tumores Sólidos (RECIST), criterios internacionalmente usados para comprobar si una terapia funciona y definir si el paciente con cáncer está respondiendo adecuadamente al tratamiento. Los autores concluyen que la PET con FDG ha demostrado ser un marcador biológico eficaz para la evaluación de la respuesta intratumoral de los ant-EGFR en pacientes con CaECC avanzado. La actividad antitumoral se evidenció por la disminución del índice metabólico intratumoral, confirmado por los resultados de la histopatología.
Existen otros estudios que valoran los receptores del EGFR utilizando otros marcadores biomoleculares tanto con la técnica SPECT con Tc99m-IOR-EgF-R3 como PET con 18F-F-peg6-IPQA. Cruz Rivero et al.(64) estudiaron pacientes con tumores epiteliales malignos de cabeza y cuello, ya fuesen primarios, recidivantes o metastásicos, utilizando el anticuerpo monoclonal anti-EGFR IOR-EgF-R3 marcado con Tecnecio (Tc99m) para realizar inmunogammagrafía (InGG-SPECT) y determinar si este anticuerpo era capaz de detectar los tumores y/o sus metástasis. La sensibilidad para la lesión primaria fue de un 50 %; para las metástasis regionales la sensibilidad fue de un 36% y la especificidad de un 71 %. Concluyen que el anticuerpo monoclonal anti-EGFR fue útil en esta primera etapa en el diagnóstico de tumores primarios, recidivas y metástasis de cabeza y cuello.
Los estudios con PET utilizando 18F-peg6-IPQA podrían proporcionar un medio no invasivo para valorar la expresión del EGFR y la actividad de señalización en los tumores antes, durante y después del tratamiento con inhibidores del EGFR(65). Los autores están de acuerdo en que estos marcadores biomoleculares podrían ser utilizados para la selección de pacientes con cáncer a los cuales se indiquen terapia individualizada con pequeños inhibidores moleculares de la quinasa del EGFR que se usan actualmente en la clínica y que tengan una estructura similar (es decir, Iressa, Gefitinib y Erlotinib)(66).
Conclusiones
Debido a los patrones globales de la expresión génica del cáncer de cabeza y cuello, la individualización de estos pacientes mejoraría el manejo terapéutico. El tratamiento precoz de un tumor primario conduce a una reducción de la mortalidad, sobre todo si el tumor primario puede ser eliminado antes de su diseminación, en el supuesto de que no se dispone de tratamiento para este tipo de cáncer diseminado. La probabilidad de detectar el cáncer en una fase asintomática se relaciona con la tasa de crecimiento y la sensibilidad de la técnica de detección utilizada.
Referencias
- van der Waal I, de Bree R, Brakenhoff R, Coebergh JW. Early diagnosis in primary oral cancer: is it possible? Med Oral Patol Oral Cir Bucal 2011;16:e300-5.
- Begg AC, Haustermans K, Hart AA, Dische S, Saunders M, Zac-krisson B et al. The value of pretreatment cell kinetic parameters as predictors for radiotherapy outcome in head and neck cancer: a multicenter analysis. Radiother Oncol 1999;50:13-23.
- Friberg S, Mattson S. On the growth rates of human malignant tumors: implications for medical decision making. J Surg Oncol 1997;65:284-97.
- Fcinmesser R, Freeman JL, Noyek AM, Birt D. Metastatic neck disease: a clinical/ radiographic/ pathologic correlative study. Arch Otolaryngol Head Neck Surg 1987;113:1307-10.
- Avril NE, Weber WA. Monitoring response to treatment in patients utilizing PET. Radiol Clin North Am 2005;43:189-204.
- Schantz SP, Harrison LB, Hong WK. Tumors of the nasal cavity and paranasal sinuses, nasopharynx, oral cavity and oropharynx. In: Devita VT Jr, Hellman S, Rosenberg SA (eds). Cancer: Principles and Practice of Oncology. Philadelphia: JB Lippincon;1993. pp. 574-630.
- Jarret WFH. Environmental carcinogens and papillomaviruses in the pathogenesis of cancer. Proc R Soc Lond B Bioi Sci 1987;231:1-11.
- Gilison ML. Human papillomavirus-associated head and neck cancer is a distinct epidemiologic, clinical, and molecular entity. Semin Oncol 2004;31:744-54.
- Hoffman M, Gorogh T, Gottschlich S, et al. Human papillomaviruses in head and neck cancer: 8 year-survival-analysis of 73 patients. Cancer Lett 2005;218:199-206.
- Ragin C, Taioli E. Survival of squamous cell carcinoma of the head and neck in relation to human papillomavirus infection: Review and meta-analysis. Int J Cancer 2007;121:1813-20.
- Moeller BJ, Rana V, Cannon BA, Williams MD, Sturgis EM, Ginsberg LE. Prospective risk-adjusted [18F]Fluorodeoxyglucose positron emission tomography and computed tomography assessment of radiation response in head and neck cancer. J Clin Oncol 2009;27:2509-15.
- Lodish et al. Biología celular y molecular. Buenos Aires: Ed. Médica Panamericana 2005. Volver.
- Sasaki K, Murakami. T, Kawasaki M, Takahashi M. Theceilcycle associated change of the Ki-67 reactive nuclear antigen expression. J Cell Physiol 1987;133:579-84.
- van Dierendonck JH, Keijzer R, van de Velde CJH. Nuclear distribution of the Ki-67 antigen during the cell cycle: comparison with growth fraction in human breast cancer cells. Cancer Res 1989;49:2999- 3006.
- Friedlander ME, Hedley DW, Taylor JW. Clinical and biological significance of aneuploidy in human tumors. J Clin Pathol 1984;37:961-74.
- Merkel DE, McGuire WL. Ploidy, proliferative activity and prognosis. DNA flow cytometry of solid tumors. Cancer 1990;65:1194-205.
- Atkm NB, Kay R. Prognostic significance of modal DNA values and other factors in malignant tumors, based on 1465 cases. Br J Cancer 1979;:40:210-22.
- Belbin TJ, Singh B, Barber I, Socci N, Wenig B, Smith R, et al. Molecular classification of head and neck squamous cell carcinoma usingc DNA microarrays. Cancer Res 2002;62:1184–90.
- Martí-Bonmatí L, Sopena R. Los receptores y los marcadores: hacia la ciencia de la imagen a través de las hibridaciones. Radiología 2007;49:299-304.
- Minn H, Joensuu H, Ahonen A, Kiemi P. Fluoro-deoxyglucose imaging: a method to assess the proliferative activity of human cancer in vivo. Comparison with DNA flow cytometry in head and neck tumors. Cancer 1988;61:1776-81.
- DiChiro G, DeLaPaz R, Brooks R, et aI. Glucose utilization of cerebral gliomas measured by (18F)fluorodeoxyglucose and positron emission tomography. Neurology 1982;32:1323-9.
- Mineura K, Yasuda T, Kowada M, ShLshido F, Ogawa T, Uemura K. Positron emission tomographic evaluation of histological malignancy in gliomas using oxygen-15 and fluorine-18-fluorodeoxyglucose. Neurologica Res 1986;8:164-8.
- Alavi JB, Alavi A, Chawtuk J, Kushner M, et al. Positron emission tomography in patients with glioma. A predictor of prognosis. Cancer 1988;62:1074-8.
- Lodish H, Baltimore D, Berk A. Molecular cell biology. Third ed. Vol.1. Scientific American Books, New York 1995.
- Brostoff J, Scadding G, Male D, Roitt I. Inmunología clínica. Gower Medical Publishing ed. Vol. 1., London 1964.
- Pardo Mindán J, Panizo A, Martínez L. Valoración del sistema de polímeros de dextrano. En: Vision (PDE) en la detección inmunohistoquímica. Revista Española Patología 1998;31:9-16.
- Reisser C, Eichhorn K, Herold-Mende C, Born AI, Bannasch P. Expression of facilitative glucose transport proteins during development of squamous cell carcinomas of the head and neck. Int. J. Cancer 1999;80:194–8.
- Burant CF, Takeda J, Brot-Laroche E, Bell GI, Davidson NO. Fructose transporter in human spermatozoa and small intestine in GLUT5 transporter. J Biol Chem 1992;267:14523–6.
- Gould GW, Holman GD. The glucose transporter family: structure, function and tissue-specific expression. Biochem J 1993;295:329–41.
- Miller JH, Mullin JM, McAvoy E, Kleinzeller A. Polarity of transport of 2-deoxy-D-glucose and D-glucose by cultured renal epithelia (LLC-PK1). Biochim Biophys Acta 1992;1110:209–17.
- Rocha F, Malagoli R, Cándido K, Lopes Carvalho A, Werneck da Cunha I, Lourenço SV, Soares FA. Glut1 and Glut3 as potential prognostic markers for oral squamous cell carcinoma. Molecules 2010;15:2374-87.
- Brizel DM, Dodge RK, Clough RW, Dewhirst MW. Oxygenation of head and neck cancer: changes during radiotherapy and impact on treatment outcome. Radiother Oncol 1999;53:113–7.
- Nordsmark M, Bentzen SM, Rudat V, Brizel D, Lartigau E, Stadler P, et al. Prognostic value of tumor oxygenation in 397 head and neck tumors after primary radiation therapy. An international multi-center study. Radiother Oncol 2005;77:18–24.
- Hockel M, Schlenger K, Aral B, Mitze M, Schaffer U, Vaupel P. Association between tumor hypoxia and malignant progression in advanced cancer of the uterine cervix. Cancer Res 1996;56:4509–15.
- Brizel DM, Scully SP, Harrelson JM, Layfield LJ, Bean JM, Prosnitz LR, et al. Tumor oxygenation predicts for the likelihood of distant metastases in human soft tissue sarcoma. Cancer Res 1996;56:941–3.
- Teicher BA. Hypoxia and drug resistance. Cancer Metastasis Rev 1994;13:139–68.
- Schoder H, Fury M. PET monitoring of therapy response in head and neck squamous cell carcinoma. J Nuc Med 2009;50:74S-88S.
- Arias de la Vega F, Garcia–Velloso MJ. Estado actual del PET en los tumores de cabeza y cuello: Impacto en la planificación del tratamiento radioterápico. Anales Sis San Navarra 2009;32.
- Naumov GN, Akslen LA. Role of angiogenesis in human tumor dormancy: animal models of the angiogenesis switch. Cell Cycle 2006;5:1779-87.
- Watanabe A, Tanaka R, Takeda N, Washiyama K. DNA synthesis, blood flow, and glucose utilization in experimental rat brain tumors. J Neurosurg 1989;70:86-91.
- Haberkorn U, Strauss LG, Reisser C, Haag D, Dimitrakopoulou A, Ziegler S, et al. Glucose uptake, perfusion, and cell proliferation in head and neck tumors: relation of positron emission tomography to flow cytometry. J Nucl Med 1991;32:1548-55.
- Toustrup K, Sørensen BS, Nordsmark M, Busk M, Wiuf C, Alsner J, Overgaard J. Development of a hypoxia gene expression classifier with predictive impact for hypoxic modification of radiotherapy in head and neck cancer. Cancer Res 2011;71:5923-31.
- Jain RK. Normalization of tumor vasculature: an emerging concept in antiangiogenic therapy. Science 2005;307:58-62.
- Mizukami Y, Kohgo Y. Hypoxia inducible factor–1: independent pathway in tumor angiogenesis .Clin Cancer Res 2007;13:5670-4.
- Folkman J. Angiogenesis: an organizing principle for drug discovery? Nat Rev Drug Discov 2007;6:273-86.
- Kyzas PA, Stefanou D. Prognostic significance of VEGF inmunohistochemical expression and tumor angiogenesis in head and neck squamous cell carcinoma. J Cancer Res Clin Oncol 2005;131:624-30.
- Kyzas PA, Stefanou D. Prognostic significance of vascular endothelial growth factor immunohistochemical expression in head and neck squamous cell carcinoma: a meta analysis. Clin Cancer Res 2005;11:1434-40.
- Riedel F. Antiangiogenic therapy of head and neck squamous cell carcinoma by vascular endothelial growth factor antisense therapy. Adv Otorhinolaryngol 2005;62:103–20.
- Eiwert TY, Cohen EE. Targeting angiogenesis in head and neck cancer. Semin Oncol 2008;35:274-85.
- Bozec A, Gros FX. Vertical VEGF Targeting: a combination of ligand blockade with receptor tyrosine kinase inhibition. Eur J Cancer 2008;44:1922-30.
- Bozec A, Sudaka A. Combined effects of bevacizumab with erlotinib and irradiation: a preclinical study on a head and neck cancer8orthotopic model. Br J Cancer 2008;99:93-9.
- Mena E, Turkbey I. A novel PET imaging approach for detection of tumor angiogenesis via the expression of vβ3 integrin using an RGD peptide, [18F]fluciclatide (AH111585). J Nucl Med 2010;51(Suppl2):505.
- Villalobo A, Palomo-Jiménez PI, Ruano MJ. El receptor del factor de crecimiento epidérmico. Vitae: Academia Biomédica Digital, Nº. 5, 2000.
- Schlessinger J, Shreiber AB, Levi A, Liberman T, Yarden Y. Regulation of cell proliferation by epidermal growth factor. Crit Rev Biochem 1983;2:93-111.
- Gullick WR. Prevalence of aberrant expression of the epidermal growth factor receptor in human cancer. B Med Bull 1991;47:87-98.
- Heisiger EM, Hayes IR, Pierz DM, Budzilovich GN. Pronostic relevance of epidermal growth factor receptor (EGF-R) and C-Neulerb B2 expression in Glioblastomas (GB Ms). J Neuro-oncol 1993;16:93-104.
- Ozanne B, Richards CS, Haudler F, Burns D, Gusterson B. Over expression of the EGF receptor in a hallmark of squamous cell carcinomas. J Pathol 1986;149:9-14.
- Neal DE, Shaiples L, Smith K, Feunelly J, Hall RR, Havis A. The epidermal growth factor receptor and the prognosis of bladder cancer. Cancer 1990;65:1619-25.
- Bargmarm CI, Hung MC, Weinherg RA. Multiple independent activations of the new oncogene by a point mutation altering the transmembrane domain of P 185. Cell 1986;45:649-85.
- Psyrri A, Weinberger PM. Quantitative determination of nuclear and cytoplasmic epidermal growth factor receptor expression in oropharyngeal squamous cell cancer by using automated quantitative analysis. Clin Cancer Res 2005;11:5856-62.
- Burtness B, Goldwater MA. Phase III randomized trial of cisplatin plus placebo compared with cisplatin plus cetuximab in metastasic/recurrent head and neck cancer: an Eastern Cooperative Oncology Group Study. J Clin Oncol 2005;23:8646-54.
- Vermorken JB, Mesia R. Platinum–based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 2008;359:1116-27.
- Muthukrishnan A, Mountz J, Grandis J, Lai S. FDG PET-CT accurately assesses response to intratumoral epidermal growth factor receptor (EGFR) antisense (AS) DNA therapy in recurrent squamous cell carcinoma of the head and neck (SCCHN). J Nucl Med 2007;48 (Suppl 2):150P.
- Cruz T, Oliva JP, Borrón M, Pimentel G. Importancia del diagnóstico inmunogamagráfico con el antirreceptor del factor de crecimiento epidérmico en carcinomas de cabeza y cuello. Rev Cubana Oncol 1999;15:160-4.
- Medina OP, Pillarsetty N, Glekas A, Punzalan B, Longo V, Gönen M, et al. Optimizing tumor targeting of the lipophilic EGFR-binding radiotracer SKI 243 using a liposomal nanoparticle delivery system. J Control Release 2011;149:292-8.
- Yeh HH, Ogawa K, Balatoni J, Mukhapadhyay U, Pal A, Gonzalez-Lepera C, et al. Molecular imaging of active mutant L858R EGF receptor (EGFR) kinase-expressing non-small cell lung carcinomas using PET/CT. Proc Natl Acad Sci U S A. 2011;108:1603-8.
